Interventi, terapie e cure

 NEUROTECNOLOGIE
NEUROTECNOLOGIE
Un nuovo sistema di stimolazione elettrica del midollo spinale consente a tre pazienti paraplegici di recuperare parzialmente la deambulazione mediante il controllo dei muscoli delle gambe
17.11.2018
Testo dell’articolo
Nello studio STIMO (STImulation Movement Overground) un team di ricercatori di istituti svizzeri, coordinati dall’Ecole Polytechnique Fédérale de Lausanne (EPFL), ha condotto una sperimentazione che ha consentito a tre pazienti affetti da paraplegia cronica di recuperare parzialmente la deambulazione mediante una stimolazione elettrica del midollo spinale grazie ad un impianto wireless, e successive intense sessioni di riabilitazione fisica. I risultati ottenuti si basano su una profonda comprensione dei meccanismi sottostanti acquisiti dagli scienziati in anni di ricerca su modelli animali.
La loro ricerca è stata pubblicata in due diversi articoli: su Nature in Targeted neurotechnology restores walking in humans with spinal cord injury, e su Nature Neuroscience in Electrical spinal cord stimulation must preserve proprioception to enable locomotion in humans with spinal cord injury.

David Mzee, uno dei pazienti partecipanti alla sperimentazione
Un dispositivo che stimola elettricamente la superficie del midollo spinale mediante impulsi elettrici è riuscito ad indurre movimenti coordinati alle ginocchia e alle caviglie, permettendo alle gambe i movimenti adatti alla camminata. La sperimentazione ha dimostrato che il cervello è in grado d’interagire con lo stimolatore elettrico, consentendo ai pazienti di mantenere il controllo dei movimenti, e di determinare il tempo e l’ampiezza del passo
I ricercatori sono stati in grado di simulare in tempo reale come il cervello attiva naturalmente il midollo spinale. Affinché un paziente abbia la capacità di produrre un movimento intenzionale sono cruciali il momento esatto e la posizione della stimolazione elettrica: ed è anche questa coincidenza spazio-temporale che fa scattare la crescita di nuove connessioni nervose.
Dopo diversi mesi di stimolazione, l’integrazione tra il sistema nervoso e il dispositivo ha permesso al cervello di comandare i muscoli precedentemente paralizzati anche senza che lo stimolatore fosse attivo. Solo dopo una settimana di calibrazione i tre i partecipanti allo studio sono stati in grado di camminare con il supporto del peso corporeo, ed il controllo volontario dei muscoli è migliorato enormemente entro cinque mesi dall’inizio dell’allenamento.
Il sistema nervoso umano ha risposto alla stimolazione più di quanto i ricercatori stessi si aspettassero. Secondo loro questi periodi di addestramento più lunghi e ad alta intensità si sono dimostrati fondamentali per innescare la plasticità dipendente dall’attività, ovvero l’intrinseca capacità del sistema nervoso di riorganizzare le fibre nervose. Ciò ha portato a migliorare la funzione motoria anche quando la stimolazione elettrica viene disattivata. La stimolazione con impulsi elettrici è stata infatti in grado di promuovere la locomozione preservando al contempo i segnali sensoriali provenienti dalle gambe.
Lo studio condotto ha quindi rilevato come i nuovi protocolli di riabilitazione, basati sull’approccio con questa neurotecnologia, hanno portato ad un significativo miglioramento della funzione neurologica, consentendo ai pazienti di allenare attivamente le capacità naturali della camminata per lunghi periodi di tempo.
Testo redatto su fonte EPFL del 31 ottobre 2018
Per approfondimenti:
Targeted neurotechnology restores walking in humans with spinal cord injury, DOI: 10.1038/s41586-018-0649-2 – Nature | 31.10.2018
Electrical spinal cord stimulation must preserve proprioception to enable locomotion in humans with spinal cord injury, DOI: 10.1038/s41593-018-0262-6 – Nature Neuroscience | 31.10.2018
Images credit: EPFL/Jamani Caillet
© Copyright ADEPRON – Riproduzione riservata

 MEDICINA RIGENERATIVA
MEDICINA RIGENERATIVA
Sintetizzato un materiale ibrido ingegnerizzato in grado di “mimare” il tessuto osseo e cartilagineo per stimolarne la rigenerazione se danneggiato da traumi o da patologie
14.05.2016
Testo dell’articolo
Il tessuto osseo naturale, come la cartilagine, ha una forte resistenza meccanica, ma è allo stesso tempo dinamico. I ricercatori hanno studiato il modo per mimare queste caratteristiche con materiali sintetici. E utilizzando una componente inorganica a base di silicio con una nuova matrice organica mai utilizzata prima è stato creato un materiale con caratteristiche molto particolari, che possono anche essere modulate cambiando i rapporti tra le componenti organiche e inorganiche. Il materiale è così in grado di auto-ripararsi in caso di fratture nette o in caso di scheggiature, è elastico, resiste alla compressione e alla trazione.
In natura l’elasticità e la resistenza sono date dalla compartecipazione della matrice inorganica rigida e resistente, componente minerale calcificata, con una matrice organica che conferisce elasticità, la cosiddetta componente proteica. Da anni si stanno cercando dei sostituti ossei capaci di mimare le proprietà dell’osso naturale; per ottenere caratteristiche analoghe si preparano materiali definiti “ibridi” costituiti da una componente inorganica, spesso a base di silicio, e da una componente organica di tipologia estremamente variabile. Con questa ricerca si è riusciti a sintetizzare un materiale che unisce entrambe le caratteristiche.
Lo studio dimostra che il nuovo materiale sviluppato pone le basi di partenza per lo sviluppo di nuove strategie di cura e per realizzare in laboratorio, per la prima volta, un nuovo materiale mimetico del tessuto cartilagineo. Grazie alle caratteristiche modulabili, verrà studiato il suo utilizzo nell’ambito della medicina rigenerativa. In particolare, dopo un’ulteriore fase di ricerca, si potrebbe giungere alla realizzazione di un materiale che, opportunamente ingegnerizzato, mimi il tessuto e ne stimoli la riparazione, fino ad arrivare alla rigenerazione della cartilagine consumata o danneggiata sia a livello del menisco sia a livello dei dischi intervertebrali.
C’è ancora molta strada da fare e sarà necessario diverso tempo e uno sviluppo approfondito delle ricerche prima che questa tecnologia possa essere applicata nell’uomo, ma il risultato raggiunto è un passo importante per una nuova medicina di frontiera.
Testo redatto su fonte Università di Milano-Bicocca del 12 maggio 2016
Image credit: Imperial College London
© Copyright ADEPRON – Riproduzione riservata

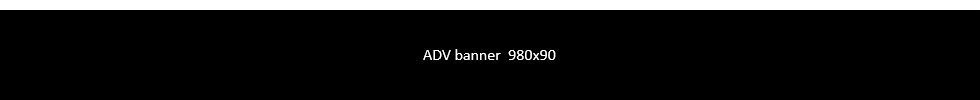
 CHIRURGIA DELL’OCCHIO
CHIRURGIA DELL’OCCHIO
Trapianto di cornea: grazie ad una nuova procedura basata su una tecnologia laser ad altissima precisione, i pazienti pediatrici recuperano la vista riducendo il rischio di rigetto
01.03.2016
Testo dell’articolo
Indicata principalmente per il trattamento del cheratocono, la BBFF si basa sull’utilizzo della tecnologia ad altissima precisione del laser a femtosecondi, un’apparecchiatura disponibile in pochissime strutture pediatriche del mondo. Essa è un’evoluzione della Big-Bubble, tecnica che oggi viene considerata la migliore opzione chirurgica in caso di indicazione alla cheratoplastica lamellare anteriore, vale a dire al trapianto parziale effettuato con l’uso del laser per l’asportazione in lamelle della parte malata e più superficiale della cornea. Il metodo Big-Bubble tuttavia, a causa delle sue difficoltà tecniche, viene utilizzato nel mondo da un numero limitato di chirurghi. La nuova procedura invece è più sicura e più facile da eseguire, e può consentire a più specialisti di cimentarsi con questo tipo di chirurgia dell’occhio, diventando uno standard internazionale per il trattamento di alcune patologie della cornea.
Il laser a femtosecondi crea una lamella, cioè taglia una “fettina” di cornea, corrispondente alla parte malata che viene asportata e sostituita con una lamella della stessa forma e spessore, anch’essa preparata dal laser dalla cornea del donatore. Prima di eseguire l’operazione di “slamellamento”, la parte sana della cornea del paziente, l’endotelio, viene separata dagli strati superiori con una bolla d’aria. L’evoluzione della nuova tecnica consiste nel creare un percorso calcolato e guidato dal laser per arrivare senza margine di errore al punto in cui insufflare l’aria. Nella Big-Bubble tradizionale questa fase della procedura (la più complessa) è lasciata all’expertise del chirurgo e viene eseguita “a mano libera”, utilizzando un apposito trapano e una cannula, con un elevato rischio di perforare l’endotelio. L’introduzione del laser ad altissima precisione (il margine di errore è di soli 4 micron, ovvero 4 millesimi di millimetro) anche in una fase così delicata e complicata dell’intervento, semplifica l’intera procedura, rendendola applicabile su più vasta scala. I vantaggi per i pazienti pediatrici sono notevoli perché garantisce un ridotta percentuale di rigetto e un ottimo recupero della vista ottenibili con maggior sicurezza e ripetibilità.
La BBFF si utilizza in caso di patologie e lesioni che interessano gli strati anteriori della cornea (in particolare lo stroma) senza il coinvolgimento della parte più profonda, l’endotelio, la cui conservazione abbatte il rischio di rigetto. Si utilizza questa tecnica quando l’occhio perde la sua capacità di vedere perché la cornea è danneggiata gravemente a causa di patologie come il cheratocono (malattia rara e degenerativa che deforma la cornea distorcendo le immagini) o di infezioni che hanno prodotto cicatrici (leucoma corneale). In questi casi si restituisce trasparenza alla superficie oculare mediante la sostituzione parziale di tessuto, che si preleva da un donatore cadavere. Quando anche l’endotelio è compromesso si ricorre invece al trapianto a tutto spessore, ovvero alla cheratoplastica perforante che prevede la sostituzione di tutta la cornea.
Testo redatto su fonte Ospedale Pediatrico Bambino Gesù – IRCCS di Roma del 22 gennaio 2016
Per approfondimenti: The Big-Bubble Full Femtosecond Laser-Assisted Technique in Deep Anterior Lamellar Keratoplasty, DOI: 10.3928/1081597X-20151111-07 – Journal of Refractive Surgery | 10.12.2015
Image credit: Alcon/Novartis, 2013
© Copyright ADEPRON – Riproduzione riservata

 BIOMATERIALI
BIOMATERIALI
Il CNR sviluppa e sperimenta un biomateriale in grado di rigenerare i tessuti danneggiati da patologie, neoplasie e traumi, e utilizza i bioreattori per lo studio dei tumori
22.01.2016
Testo dell’articolo
Questo tipo di materiale può essere testato e validato, in fase pre-clinica, all’interno di bioreattori, “laboratori portatili” in grado di riprodurre in vitro condizioni fisiologiche sia sane che patologiche, consentendo, nel contempo, di ridurre drasticamente la sperimentazione animale. Le applicazioni dei bioreattori sono molteplici: da un lato, all’interno di essi si possono testare, da un punto di vista meccanico e di biocompatibilità, protesi di nuova generazione in grado di rigenerare tessuti naturali oltre che resistere a carichi meccanici tipici per esempio dei tessuti articolari; dall’altro, essi consentono di studiare sotto una lente d’ingrandimento alcuni aspetti critici delle malattie, come l’insorgenza di metastasi, in ambienti tridimensionali realistici, quasi come se fossero studiati dal vivo. L’utilizzo di bioreattori per lo studio dei tumori è una conquista recente, praticata in pochissimi laboratori in tutta Europa, e in Italia solo al CNR di Genova.
Testo redatto su fonte CNR del 18 gennaio 2016
Image credit: Consiglio Nazionale delle Ricerche
© Copyright ADEPRON – Riproduzione riservata

 TERAPIE ONCOLOGICHE
TERAPIE ONCOLOGICHE
Un progetto italiano svilupperà vettori intelligenti per il rilascio di farmaci anti-tumorali nei tessuti malati, mediante l’uso di terapie “personalizzate” sul profilo dei pazienti
29.11.2015
Testo dell’articolo
In quest’ambito, l’Istituto Italiano di Tecnologia (IIT) e l’Ospedale Galliera di Genova hanno sottoscritto un accordo che prevede lo sviluppo di un programma di medicina personalizzata, che coniugando nanotecnologie, genetica e scienza dei farmaci si pone l’obiettivo di sperimentare nell’arco dei prossimi 3-5 anni una nuova terapia per il tumore al colon-retto. Obiettivo dell’accordo tra i due Istituti genovesi è quello di arrivare nel breve termine all’identificazione di terapie anti-tumorali personalizzate, specifiche per le neoplasie al colon-retto (nelle quali il rilascio del farmaco direttamente sul tessuto malato è definito nei tempi, quantità e tipologia in base al profilo genetico del paziente), e, successivamente, di inserire queste terapie nella sperimentazione clinica, osservandone l’efficacia.
Nel Laboratorio di Nanotecnologie per la Medicina di Precisione dell’IIT si sviluppano nanoparticelle di materiale polimerico biodegradabile che avranno il compito di agire da navicelle su cui caricare più molecole di farmaco antitumorale e rilasciarle direttamente sul tessuto malato. La collaborazione con il Galliera permetterà di perfezionare tali nanoparticelle, in modo che siano “personalizzate” sul profilo del paziente. Il tumore, infatti, differisce da paziente a paziente sia per le differenze genetiche degli individui, sia per le caratteristiche specifiche del singolo tratto intestinale, cioè architettura vascolare e tissutale. I ricercatori, quindi, svilupperanno modelli pre-clinici che replicano le caratteristiche specifiche di ciascun malato e vi testeranno l’efficacia dei vettori nanotecnologici.
Il vantaggio di questo approccio è notevole poiché consentirà di identificare per ogni singolo paziente la tipologia di particella e la combinazione farmacologica che con più alta probabilità porterà alla remissione della malattia. A regime, sarà possibile realizzare il modello pre-clinico del paziente specifico in qualche settimana, testare le varie combinazioni sul modello pre-clinico, ed infine somministrare al paziente solo la soluzione più efficacie. Grazie inoltre all’esperienza maturata nella S. C. Oncologia medica del Galliera, la terapia farmacologica per il tumore colon-retto sarà per la prima volta di tipo combinatoriale, ovvero saranno due i farmaci rilasciati dalle nanoparticelle: uno che blocca il tumore e l’altro che allevia gli stati infiammatori corresponsabili della proliferazione tumorale.
L’approccio proposto costituisce un nuovo esempio di medicina di precisione dove, ai classici farmaci fino ad ora utilizzati, si associa l’uso di integratori di origine vegetale che, attraverso le nanoparticelle possono essere somministrati in dosi altissime sfruttandone l’effetto sinergico. In questo modo, inoltre, si ha la possibilità di incrementare l’attività della terapia tradizionale, la chemioterapia, riducendone gli effetti collaterali.
Testo redatto su fonte IIT e Ospedale Galliera di Genova del 24 novembre 2015
Image credit: Istituto Italiano di Tecnologia
© Copyright ADEPRON – Riproduzione riservata

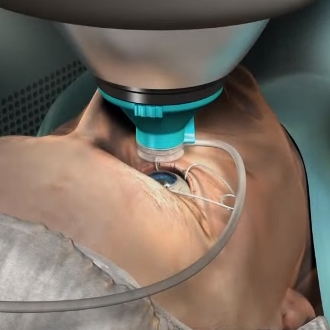
 TERAPIE ONCOLOGICHE
TERAPIE ONCOLOGICHE
Progetto FUTURA: sviluppata una piattaforma robotica flessibile a guida ecografica in grado di trattare, in maniera non invasiva e sicura, i tumori del rene e del fegato
04.11.2015
Testo dell’articolo
Finanziato dalla Comunità europea con circa 3 milioni di euro per una durata di 3 anni, al consorzio FUTURA, arrivato oggi al secondo di sviluppo sotto il coordinamento dell’Istituto di BioRobotica della Scuola Superiore Sant’Anna di Pisa, partecipano Università, centri di ricerca e aziende europee.
Nello specifico è costituita da due bracci robotici a sei gradi di libertà e da un generatore HIFU progettato e sviluppato nell’ambito del progetto FUTURA. La flessibilità e la guida robotica permettono di indirizzare il fascio terapeutico degli ultrasuoni anche su organi interni mobili, altrimenti non raggiungibili con le tecnologie di indirizzamento oggi disponibili. Grazie alla focalizzazione e alla alta potenza degli ultrasuoni, la piattaforma provoca la necrosi del tessuto tumorale, ovvero ne causa la morte delle cellule malate.
L’utilizzo della tecnologia comporta per i pazienti vantaggi significativi, oltre a migliorare la degenza e la convalescenza: la lesione tumorale può essere trattata senza provocare danni collaterali ai tessuti sani, senza inserire aghi e senza ricorrere alle tradizionali incisioni col bisturi. L’affiancamento della robotica con le “machine learning” (intelligenza artificiale che garantisce l’apprendimento automatico della procedura) alla terapia tradizionale HIFU garantisce la flessibilità dell’intervento, l’ottimizzazione della procedura di termoablazione (cioè di “distruzione del tumore” mediante l’innalzamento della temperatura), la precisione, l’accuratezza e la riduzione della durata del trattamento.
Il punto di partenza di questo ambizioso progetto sono state le competenze di primissimo livello nei campi della robotica, della bioingegneria, degli HIFU, dell’imaging ecografico e del “machine learning” del team di ricerca. FUTURA attualmente si trova nella fase di integrazione dei componenti per la successiva validazione sperimentale e quindi per la valutazione finale dei risultati raggiunti in termini di precisione, flessibilità ed efficacia della terapia. I test su modello umano inizieranno nei prossimi mesi, presso il Centro di Chirurgia Sperimentale dell’Università di Dundee (Inghilterra), con l’obiettivo di garantire l’utilizzo della piattaforma in una reale sala operatoria nel più breve tempo possibile.
Testo redatto su fonte Scuola Universitaria Superiore Sant’Anna di Pisa del 3 novembre 2015
Per approfondimenti sul progetto FUTURA: www.futuraproject.eu
Image credit: Scuola Universitaria Superiore Sant’Anna di Pisa
© Copyright ADEPRON – Riproduzione riservata

 MEDICINA RIGENERATIVA
MEDICINA RIGENERATIVA
Rigenerazione muscolare in vivo: sintetizzati gli HELP, biopolimeri ad elevata biocompatibilità, idonei a realizzare materiali biomimetici “intelligenti” di nuova generazione
11.10.2015
Testo dell’articolo
Un team di ricerca del Dipartimento di Scienze della Vita dell’Università di Trieste ha sintetizzato, mediante la tecnologia del DNA ricombinante, i biopolimeri HELP (Human Elastin-Like Polypeptides) che, derivati dall’elastina umana, mantengono diverse proprietà peculiari di questa proteina fisiologicamente presente nella matrice di molti tessuti. Questi biopolimeri, dotati di ottima biocompatibilità, ben si prestano per la realizzazione di materiali biomimetici “intelligenti” di nuova generazione, il cui comportamento risponde alle condizioni dell’ambiente circostante e di conseguenza, li rende in grado di interagire con la componente biologica a livello cellulare. Tre di questi polipeptidi, differenti tra loro per alcune piccole porzioni della sequenza aminoacidica, sono stati saggiati come substrati di adesione per cellule di origine mioblastica, precursori delle fibre muscolari.
Lo studio, pubblicato su Biomaterials dal titolo “In vitro myogenesis induced by human recombinant elastin-like proteins” ha dimostrato che, non solo i polipeptidi HELP stimolano il differenziamento miogenico di queste cellule, ma, soprattutto, che l’entità ed il tipo delle risposte cellulari dipendono strettamente dalla sequenza aminoacidica del polipeptide utilizzato. I risultati ottenuti indicano che le proprietà dei polipeptidi HELP possono essere sfruttate da un lato per chiarire con maggior dettaglio i meccanismi molecolari responsabili dello sviluppo del muscolo scheletrico, dall’altro come basi di partenza per nuove strategie volte a promuovere, in vivo, la rigenerazione muscolare.
Testo redatto su fonte Università di Trieste dell’8 ottobre 2015
Per approfondimenti: In vitro myogenesis induced by human recombinant elastin-like proteins, DOI: 10.1016/j.biomaterials.2015.07.041 – Biomaterials | 01.10.2015
Image credit: Olivier Pourquie/Brigham and Women’s Hospital
© Copyright ADEPRON – Riproduzione riservata

 BIO-MEDICINA SPAZIALE
BIO-MEDICINA SPAZIALE
Realizzato in orbita, “Endothelial cells” è un progetto ESA finalizzato a comprendere l’influenza della microgravità sui meccanismi di invecchiamento delle cellule endoteliali
06.10.2015
Testo dell’articolo
La permanenza in assenza di gravità si comporta come una sorta di “macchina del tempo” che rende più “anziane” le cellule del nostro corpo in pochi giorni terrestri. A causa di questo motivo gli astronauti sono soggetti ad un invecchiamento precoce, ma reversibile, che simula in maniera fedele ciò che avviene sulla Terra in tempi molto più lunghi e in modo certamente non reversibile. Questo rende lo spazio un “laboratorio ideale” per comprendere come la microgravità influenza l’invecchiamento delle cellule endoteliali, offrendo agli scienziati strumenti di conoscenza importanti nell’ambito della prevenzione e della cura di malattie “terrestri”.
Con questa finalità è nato “Endothelial cells“, il progetto italiano di bio-medicina spaziale, coordinato da Debora Angeloni della Scuola Superiore Sant’Anna di Pisa, selezionato dall’European Space Agency (ESA) e sostenuto con il finanziamento dell’Agenzia Spaziale Italiana (ASI). Il progetto è culminato con l’invio in orbita, mediante un vettore Soyuz, di campioni di cellule endoteliali umane a bordo dell’International Space Station (ISS). Qui sono cresciute e si sono riprodotte all’interno di microlaboratori progettati e realizzati ad hoc per esperimenti di biologia cellulare in condizioni di microgravità. Per l’esperimento è stata utilizzata anche Kubik, la centrifuga/incubatrice autonoma ad alta tecnologia dell’ESA (immagine nel riquadro) in grado di sottoporre campioni biologici all’effetto della gravità terrestre.
Le cellule sono state inviate nello spazio con un lancio, dal cosmodromo di Baikonur (Kazakhstan), a bordo della Soyuz TMA-18M/Mission 44S il 2 settembre scorso, e sono state riportate a terra (in ottimo stato) a bordo della Soyuz TMA-16M/Mission 42S il 12 settembre.
Sui campioni sarà condotta un’ampia ricerca di biologia molecolare per raggiungere importanti obiettivi, sia a breve e che a lungo termine:
– l’obiettivo a breve termine sarà caratterizzare i meccanismi molecolari attivati dalla permanenza nello spazio (gli stessi che probabilmente sono attivati anche dall’invecchiamento fisiologico dell’endotelio);
– l’obiettivo a lungo termine sarà mettere a punto metodi per la prevenzione e la riabilitazione utili, non soltanto per gli astronauti (in particolare per quelli degli equipaggi che parteciperanno alle future missioni spaziali di lunga durata, come ad esempio quella su Marte), ma anche per un grande numero di pazienti “terrestri”.
Testo redatto su fonte Scuola Superiore Sant’Anna di Pisa dell’1 ottobre 2015
Image credit: European Space Agency (ESA)
© Copyright ADEPRON – Riproduzione riservata

 TRAPIANTI DI ORGANI E TESSUTI
TRAPIANTI DI ORGANI E TESSUTI
Al Niguarda eseguito un eccezionale trapianto di fegato da donatore a cuore non battente, secondo una procedura mai utilizzata prima in Italia per questo tipo di organo
24.09.2015
Testo dell’articolo
Definita tecnicamente “trapianto da donatore a cuore non battente”, la procedura utilizzata si differenzia dal protocollo tradizionale per il prelievo degli organi (il quale normalmente avviene da un donatore in stato di morte cerebrale). In questo caso, infatti, il decesso è stato dichiarato in seguito alla cessazione dell’attività cardiaca ed il prelievo è stato effettuato rispettando il “no touch period”, ossia il periodo di osservazione che conclude il processo dell’accertamento di morte (in Italia questo periodo è di 20 minuti, mentre nel resto d’Europa è di 5 minuti). Si tratta quindi di un caso di rilievo scientifico internazionale.
Il prelievo del fegato (insieme ai due reni) è stato possibile grazie alle ECMO (ExtraCorporeal Membrane Oxygenation), particolari tecniche di circolazione extracorporea che hanno consentito la perfusione e l’ossigenazione post-mortem e in situ degli organi addominali per 4 ore, attivata dopo i 20 minuti di arresto cardiaco. Queste misure sono state adottate per mantenere la normale temperatura corporea e per ritardare il danno da ischemia (mancata ossigenazione), principale minaccia che rischia di compromettere l’utilizzo degli organi per il trapianto.
L’importante risultato ottenuto con questo trapianto rappresenta quindi una concreta possibilità su cui puntare sempre più per aumentare il numero delle donazioni di fegato e abbattere i tempi di attesa, che in Italia sono mediamente di 2 anni.
Testo redatto su fonte Ospedale di Niguarda Ca’ Grande del 14 settembre 2015
Image credit: Tareq Salahuddin/Flickr
© Copyright ADEPRON – Riproduzione riservata

 NEUROMODULAZIONE
NEUROMODULAZIONE
Sviluppato il neurone sintetico, un dispositivo che, capace di comunicare con le cellule nervose umane, migliorerà le terapie per le malattie legate ai disordini neurologici
10.09.2015
Testo dell’articolo
Al suo interno non vi sono parti “viventi” poiché è composto da un materiale plastico conduttivo, cioè un polimero nel quale possono scorrere segnali elettrici. In particolare, l’unità sintetica è costituita da un biosensore sensibile ai cambiamenti dell’ambiente circostante, e quindi in grado di interpretare i segnali chimici esterni, e da una parte che trasforma tali cambiamenti in segnali elettrici. Questi ultimi, mediante una pompa ionica, vengono poi convertiti nuovamente in segnali chimici il cui effetto sulle cellule umane vive può essere monitorato osservando il rilascio del neurotrasmettitore.
Lo studio, presentato su Biosensors & Bioelectronics nell’articolo “An organic electronic biomimetic neuron enables auto-regulated neuromodulation“, apre la strada ad un potenziale miglioramento delle terapie per la cura delle malattie legate ai disordini del sistema nervoso, terapie che si basano ancora sulla tradizionale stimolazione elettrica. Fino ad ora, infatti, si è cercato di ripristinare la funzionalità trasmettendo dei segnali elettrici dall’esterno, ma la tecnica si è sempre rivelata inadatta perché la stimolazione crea un disturbo generalizzato ai segnali di tutte le cellule nervose dell’area interessata, comprese anche quelle non compromesse dalla malattia.
Per questo, il prossimo obiettivo dei ricercatori svedesi sarà quello di miniaturizzare il dispositivo (attualmente lungo pochi centimetri) per renderlo adatto ad essere impiantato nel corpo umano. In tal modo potrà essere possibile inserire cellule artificiali nell’organismo per ripristinare le zone danneggiate con interventi mirati “intelligenti” o controllati esternamente via wireless.
Testo redatto su fonte Karolinska Institutet del 24 giugno 2015
Per approfondimenti: An organic electronic biomimetic neuron enables auto-regulated neuromodulation, DOI: 10.1016/j.bios.2015.04.058 – Biosensors & Bioelectronics | 22.04.2015
Image credit: Karolinska Institutet/Erik Cronberg
© Copyright ADEPRON – Riproduzione riservata

 STIMOLAZIONE NEURALE
STIMOLAZIONE NEURALE
Grazie all’impiego di nanoparticelle piezoelettriche (nanomateriali “smart”), potrebbe essere possibile trattare il Parkinson stimolando le cellule neuronali via “wireless”
03.08.2015
Testo dell’articolo
Pubblicato nell’articolo “Piezoelectric Nanoparticle-Assisted Wireless Neuronal Stimulation” sulla rivista “ACS Nano”, il risultato è frutto della ricerca condotta da un team internazionale, in collaborazione con il laboratorio “Wabios” (Waseda University, Tokyo), con il coordinamento e con l’apporto fondamentale di un gruppo di scienziati italiani del Centro di Micro-BioRobotica dell’Istituto Italiano di Tecnologia (IIT) e dell’Istituto di BioRobotica della Scuola Superiore Sant’Anna di Pisa.
Lo studio ha analizzato nel dettaglio il meccanismo che porta alla stimolazione neuronale, individuando i canali della membrana cellulare coinvolti nel fenomeno, dimostrando come la piezoelettricità delle nanoparticelle sia il requisito fondamentale per ottenere l’eccitazione neuronale.
I risultati della ricerca pongono le basi per un nuovo approccio alla stimolazione cellulare “wireless”, minimamente invasivo, perché privo di elettrodi connessi con il paziente, e biocompatibile, grazie all’assenza di tossicità del titanato di bario ed alla totale sicurezza della stimolazione ultrasonica (già assai diffusa nella pratica medica).
I possibili impieghi di questa scoperta sono molteplici e aprono prospettive interessanti in molti ambiti, dalla neuroprostetica alla medicina rigenerativa. Un potenziale utilizzo riguarda il trattamento di patologie in cui è necessaria una stimolazione neurale, come il Parkinson, mentre altre applicazioni potrebbero riguardare la rigenerazione del nervo periferico e la stimolazione sensoriale, come ad esempio la stimolazione del nervo acustico nel caso di alcune tipologie di sordità. La tecnica, comunque, non è limitata al sistema nervoso perché potrebbe essere sfruttata anche per la stimolazione di altri tessuti biologici eccitabili, come il tessuto muscolare e quello cardiaco.
Testo redatto su fonte Istituto Italiano di Tecnologia del 24 luglio 2015
Per approfondimenti: Piezoelectric Nanoparticle-Assisted Wireless Neuronal Stimulation, DOI: 10.1021/acsnano.5b03162 – ACS Nano | 13.07.2015
Image credit: ACS Nano, 2015 – DOI: 10.1021/acsnano.5b03162
© Copyright ADEPRON – Riproduzione riservata

 CHIRURGIA ONCOLOGICA
CHIRURGIA ONCOLOGICA
Sviluppata in Italia un’innovativa tecnica di chirurgia radioguidata che consentirà di asportare completamente alcune tipologie di tumori con una notevole precisione
31.01.2015
Testo dell’articolo
La chirurgia radioguidata è una tecnica che mira all’identificazione di residui tumorali per permettere una completa resezione in sede operatoria. Si inietta una sostanza radioattiva (un radiofarmaco) che si lega preferenzialmente alle cellule tumorali. Si attende che il farmaco sia metabolizzato e poi, durante l’operazione per l’asporto del tumore, si usa un dispositivo (sonda) in grado di rivelare la radiazione per verificare tessuti su cui si ha il dubbio se siano tumorali o meno. Alla fine della resezione, sempre durante l’operazione, si può usare la stessa sonda per verificare se siano rimasti residui. Le tecniche di chirurgia radioguidata adottate oggi fanno tutte uso di radiofarmaci che emettono raggi gamma. Questi ultimi attraversano grossi spessori di materiale e sono pertanto utilizzati comunemente in diagnostica medica (in particolare nella PET e nella scintigrafia), e sono dunque un naturale punto di partenza per questa diagnostica. Il loro potere penetrante però comporta che, se c’è un organo fortemente captante in prossimità del tumore, esso emette un segnale che oscura qualunque segnale proveniente dai residui tumorali. Inoltre, il personale medico viene investito da una significativa dose di radiazione a meno di tenere le attività del radiofarmaco molto basse. Queste limitazioni rendono la chirurgia radioguidata non applicabile a tumori quali quelli cerebrali (vista l’alta captazione del cervello sano), dell’addome (in prossimità di reni, vescica, fegato, per esempio) e pediatrici (dove tutte le dimensioni sono ridotte).
“Per superare queste limitazioni – spiega Riccardo Faccini, professore all’Università La Sapienza associato all’INFN – il nostro gruppo di ricerca propone un cambio di paradigma, cioè utilizzare radiofarmaci che emettano radiazione ((β-)), invece che gamma: gli elettroni infatti hanno una capacità penetrante ridotta rispetto ai fotoni”. “Il vantaggio di questa innovazione – prosegue Faccini – è che la scarsa penetrazione degli elettroni nei tessuti evita il problema della contaminazione da parte di organi sani captanti, e inoltre limita significativamente la radioattività assorbita dal personale medico”. I radiofarmaci con emissione di radiazione beta non sono mai stati usati nella diagnostica medica proprio perché gli elettroni hanno un bassissimo potere penetrante, meno di un centimetro nel corpo umano, e pertanto la radiazione emessa in condizioni normali non può uscire dal paziente. L’ambiente operatorio però consente di usare anche la radiazione beta-, dal momento che il chirurgo accede direttamente al tessuto che eventualmente emette la radiazione.
Dal punto di vista dell’applicazione di questo principio, la difficoltà principale è individuare i casi clinici in cui è essenziale una resezione completa del tumore e per i quali esista un radiofarmaco opportuno, cioè che emetta elettroni. Con l’ausilio dei medici nucleari, dei neurochirurghi e dei chirurghi addominali, i ricercatori hanno concluso che era opportuno cominciare a sperimentare la tecnica su tumori cerebrali, quali il meningioma e il glioma e sui tumori neuroendocrini, visto che per questi esiste un farmaco, l’Y90-DOTATOC già utilizzato per una particolare forma di radioterapia metabolica. “Lo studio di questa tecnica – spiega Faccini – si è concentrato finora sullo sviluppo della sonda, sulla simulazione della sensitività della tecnica e sulla valutazione a partire da immagini diagnostiche, della capacità dei tumori e dei tessuti sani limitrofi di captare il radiofarmaco”. “E credo sia importante sottolineare in questa impresa la piena multidisciplinarità: la collaborazione, infatti, vede veramente sullo stesso piano fisici, ingegneri, medici nucleari, oncologi e chirurghi”, conclude Faccini.
Testo redatto su fonte Università “La Sapienza” di Roma del 30 gennaio 2015
Per approfondimenti: Toward Radioguided Surgery with β− Decays: Uptake of a Somatostatin Analogue, DOTATOC, in Meningioma and High-Grade Glioma, DOI: 10.2967/jnumed.114.145995 – The Journal of Nuclear Medicine | 11.12.2014
Image credit: Università “La Sapienza” di Roma
© Copyright ADEPRON – Riproduzione riservata

 TERAPIE ONCOLOGICHE
TERAPIE ONCOLOGICHE
Mediante l’utilizzo di nanoparticelle d’oro, una ricerca italiana sviluppa un nuovo tipo di trattamento delle cellule cancerose per scopi sia diagnostici che terapeutici
04.01.2015
Testo dell’articolo
Fulvio Ratto, coordinatore dello studio “Plasmonic Particles that Hit Hypoxic Cells” (pubblicato su “Advanced Functional Materials”) e ricercatore dell’IFAC-CNR spiega che “le cellule tumorali si distinguono da quelle sane per la loro ‘sete’ di ossigeno. Con il nostro lavoro abbiamo scoperto che proprio le caratteristiche sviluppate per far fronte all’ipossia possono essere utilizzate per la loro individuazione. In particolare, abbiamo constatato che le cellule cancerose ipossiche reagiscono alla carenza di ossigeno esprimendo sulla membrana un enzima chiamato anidrasi carbonica 9 (Ca9). Noi abbiamo reso riconoscibile questa sorta di impronta da parte di nanoparticelle d’oro fornite di un inibitore di Ca9, per esempio un sulfamidico: le nanoparticelle in tal modo identificano e attaccano le cellule tumorali ipossiche, che sono le più difficili da raggiungere con le terapie convenzionali”.
Una volta legate in maniera selettiva a queste cellule, le nanoparticelle possono essere attivate con un laser per scopi sia diagnostici che terapeutici. “A seconda del regime di esposizione luminosa, le nanoparticelle generano ultrasuoni oppure calore, che potrebbero essere rispettivamente impiegati per l’imaging diagnostico oppure per la rimozione ipertermica delle cellule maligne”, prosegue Ratto. “In pratica, le nanoparticelle d’oro possono evidenziare la presenza delle masse tumorali oppure distruggere con il calore le cellule che le compongono”.
Gli esperimenti condotti finora sono stati effettuati su cellule coltivate in laboratorio e dimostrano che, non appena subentrano le condizioni di ipossia, le cellule cancerose possono essere efficacemente riconosciute e distrutte. Secondo Ratto “la strada per applicare questa tecnologia all’uomo è però ancora lunga: sarà infatti necessaria una complessa fase di test preclinici in modelli animali, prima di accedere alla sperimentazione clinica. Tuttavia, abbiamo ragione di ritenere che la sinergia tra nanotecnologie, biofotonica e biologia cellulare – la disciplina alla base di questa ricerca – potrà fornire uno strumento efficiente e versatile per la diagnosi e la cura di molti tumori”.
Testo redatto su fonte CNR del 18 dicembre 2014
Per approfondimenti: Plasmonic Particles that Hit Hypoxic Cells – Advanced Functional Materials | 20.11.2014
Image credit: NCI – National Cancer Institute
© Copyright ADEPRON – Riproduzione riservata

 EMODINAMICA E CARDIOLOGIA INTERVENTISTICA
EMODINAMICA E CARDIOLOGIA INTERVENTISTICA
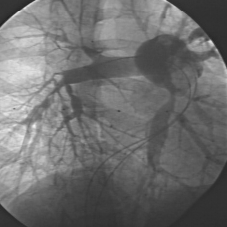
Per la prima volta in Italia, all’Ospedale Infantile Regina Margherita di Torino un eccezionale intervento ha creato un vaso sanguigno artificiale ad un bimbo di 4 anni
12.12.2014
Testo dell’articolo
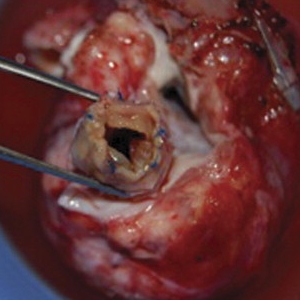
La Dott.ssa Gabriella Agnoletti, Direttore della Struttura Complessa “Cardiologia Pediatrica” dell’Ospedale Infantile Regina Margherita (OIRM) della Città della Salute di Torino, usando vasi collaterali e stent coperti, ha creato ad hoc un nuovo vaso sanguigno artificiale alternativo a quelli naturali occlusi e prima inesistente, in posizione di succlavia sinistra per permettere l’accesso al cuore. In seguito, utilizzando la nuova via creata ad hoc verso il cuore, la stessa Agnoletti, insieme al Dott. Luca Deorsola, della équipe di Cardiochirurgia pediatrica diretta dal Dott. Carlo Pace, in Sala di Emodinamica, ha posizionato un nuovo catetere centrale che arriva al cuore attraverso il nuovo vaso sanguigno e permette la dialisi. Si tratta del primo caso italiano pediatrico di apertura totale di un vaso toracico per permettere la vita di un bimbo.
Testo redatto su fonte Città della Salute e della Scienza di Torino del 12 dicembre 2014
Image credit: OIRM/G. Agnoletti
© Copyright ADEPRON – Riproduzione riservata

 EMODINAMICA E CARDIOLOGIA INTERVENTISTICA
EMODINAMICA E CARDIOLOGIA INTERVENTISTICA
Una nuova tecnica chirurgica sviluppata al Boston Children’s Hospital dà speranza ai bimbi con valvola mitralica difettosa: operati i primi 4 bambini italiani
16.04.2014
Testo dell’articolo
“Abbiamo chiesto ai colleghi americani di supportarci per eseguire il primo intervento ed insieme, vista la perfetta riuscita, abbiamo impiantato la valvola a 4 bambini italiani, tra i 6 mesi e i 6 anni di vita, due maschietti e due femminucce, tutti con almeno due interventi alle spalle per riparazione della valvola mitralica. I bambini hanno reagito ottimamente all’impianto, stanno molto meglio e sono già tornati a casa dalle loro famiglie”, continua Alessandro Frigiola. Nella sala operatoria del Policlinico San Donato, oltre ai cardiochirurghi guidati da Alessandro Frigiola, anche l’équipe del cardiologo interventista Mario Carminati, uno dei massimi esperti in Europa per le procedure eseguite sulle cardiopatie congenite negli adulti e nei bambini, colui che 20 anni fa, per la prima volta al mondo riuscì con successo ad eseguire una valvuloplastica intrauterina.
Diversamente dall’uso standardizzato di Melody, la nuova procedura pediatrica prevede un impianto cardiochirurgico, con sternotomia e circolazione extracorporea. “Assieme ai chirurghi abbiamo effettuato l’intervento a cielo aperto, portando la nostra competenza di cardiologi interventisti e la nostra “familiarità” con Melody. Abbiamo apportato modifiche lunghe e delicate alla valvola, necessarie per l’intervento in questa sede” – dice Mario Carminati – “ci sono voluti 45 minuti e suture al decimo di millimetro per adattarla alle giuste dimensioni e unirla a un collarino di pericardio che serve ad attaccarla all’anello valvolare del paziente.” Il posizionamento della valvola in sede mitralica richiede l’apertura di un passaggio tra l’atrio destro e l’atrio sinistro. Questa apertura del setto interatriale viene riparata lasciando un piccolissimo accesso, che garantisce al cardiologo interventista la possibilità di dilatare ulteriormente lo stent con la crescita del bambino, senza sottoporlo a un nuovo intervento cardiochirurgico. “È una procedura nuova di cui non conosciamo follow up a lungo termine, ma che è comunque estremamente promettente per un gruppo di pazienti per i quali, di fatto, oggi non esistono alternative soddisfacenti”, commenta Mario Carminati, Responsabile della Cardiologia Pediatrica dell’IRCCS Policlinico San Donato.
La patologia congenita della valvola mitralica, stenosi o insufficienza, è particolarmente pericolosa per i bambini e fino ad oggi priva di autentiche soluzioni. Causa grave scompenso cardiaco, dispnea, ipertensione polmonare, difficoltà di crescita. Purtroppo, porta anche al decesso prematuro. La chirurgia per la correzione del difetto valvolare non porta quasi mai a un risultato ottimale e i bambini sono costretti a subire più interventi ravvicinati per mantenere una funzionalità cardiaca accettabile. Quando possibile, si decide per la sostituzione della valvola malata, ma anche questa opzione non è definitiva: le dimensioni standard delle protesi mal si adattano ai cambiamenti fisiologici dovuti alla rapida crescita dei bambini piccoli e quindi, anche in questo caso, si è costretti a più interventi ravvicinati. Anche quando si riesce a far raggiungere al bambino una crescita adeguata per l’impianto di una valvola meccanica definitiva, si è costretti ad esporlo a una terapia con anticoagulanti, complessa da sostenere con pazienti così giovani.
Testo redatto su fonte IRCCS Policlinico San Donato del 15 aprile 2014
Per approfondimenti: Modification of a Stented Bovine Jugular Vein Conduit (Melody Valve) for Surgical Mitral Valve Replacement, DOI: 10.1016/j.athoracsur.2012.02.101 – The Annals of Thoracic Surgery | 12.2012
Image credit: The Annals of Thoracic Surgery/Elsevier Inc.
© Copyright ADEPRON – Riproduzione riservata

 TERAPIA MEDICO-NUCLEARE
TERAPIA MEDICO-NUCLEARE
INFN e CNAO siglano un accordo, per la realizzazione di tecnologie d’avanguardia, che completa la prima facility italiana interamente dedicata all’adroterapia oncologica
20.02.2014
Testo dell’articolo
“L’INFN è orgoglioso di aver potuto applicare la sua tecnologia alla medicina e, grazie al rapporto di fiducia sviluppato con il CNAO, si propone per questo importante ulteriore sviluppo che porterà vantaggio ai pazienti” ha commentato Fernando Ferroni, presidente dell’INFN.
“L’accordo di oggi è il frutto di una lunga collaborazione iniziata anni fa per la costruzione del sincrotrone; da questo accordo nasceranno ulteriori sviluppi a vantaggio dei pazienti e della ricerca, e con interessanti prospettive di divulgazione all’estero di queste nuove tecnologie di cui potranno beneficiare anche le industrie italiane” ha dichiarato Erminio Borloni, presidente del CNAO. Inaugurato quattro anni fa, il CNAO è un centro di avanguardia per la cura dei tumori (adroterapia). É, infatti, il secondo in Europa e uno dei pochi al mondo dove si eseguono trattamenti sia con protoni che con ioni carbonio, l’unico con marcatura CE e sperimentazione clinica effettuata per valutarne sicurezza ed efficacia.
L’Alta Tecnologia del CNAO è formata da un insieme di macchine acceleratrici e linee di trasporto dei fasci di particelle. I fasci sono generati da sorgenti che producono ioni carbonio e protoni. La macchina acceleratrice più importante è il sincrotrone. Il sincrotrone del CNAO è un prototipo frutto della ricerca nella Fisica delle Alte Energie, realizzato grazie alla collaborazione dell’Istituto Nazionale di Fisica Nucleare (INFN), del CERN (Svizzera), del GSI (Germania), di LPSC (Francia) e dell’Università di Pavia. Esso è stato prodotto con tecnologia principalmente italiana. L’INFN ha lavorato al progetto con le sezioni di Genova, Milano, Pavia e Torino e i Laboratori Nazionali di Frascati, Legnaro e del Sud.
L’adroterapia è una forma di radioterapia che sfrutta l’estrema precisione garantita dall’impiego dagli acceleratori di particelle sviluppati per la ricerca di base in fisica. Le cellule tumorali vengono irradiate con fasci di protoni o ioni di carbonio (adroni) emessi da un acceleratore di particelle. Con questo metodo si possono colpire tumori senza danneggiare i tessuti circostanti, permettendo trattamenti di maggiore profondità e precisione rispetto a sistemi tradizionali. Al CNAO, che nel dicembre 2013 ha concluso la fase di sperimentazione clinica, sono già stati trattati circa 180 pazienti.
APPROFONDIMENTO
Il sincrotrone del CNAO è una “ciambella” con una circonferenza di 80 metri e un diametro di circa 25; in due zone interne alla circonferenza nascono i fasci di particelle in dispositivi detti “sorgenti”. Nelle sorgenti si trova plasma formato dagli atomi dei gas, che hanno perso gli elettroni. Con campi magnetici e radiofrequenze, tali atomi vengono estratti e si selezionano i protoni e gli ioni di carbonio. Nascono allora i “pacchetti” di fasci composti, ognuno, da miliardi di particelle. Questi pacchetti sono preaccelerati e inviati nel sincrotrone dove, inizialmente, viaggiano a circa 30.000 chilometri al secondo. Successivamente sono accelerati fino ad energie cinetiche di 250 MeV per i protoni e 4.800 MeV per gli ioni carbonio (il MeV, equivalente ad un milione di elettronvolt, è l’unità di energia utilizzata nei fenomeni su scala atomica e nucleare).
Il fascio di particelle nel sincrotrone viene accelerato e percorre circa 30.000 chilometri in mezzo secondo per arrivare all’energia voluta. I fasci vengono poi inviati in una delle tre sale di trattamento. Sopra quella centrale si trova un magnete di 150 tonnellate che serve a curvare di 90 gradi il fascio di particelle e dirigerlo dall’alto sulla persona da curare. Il fascio che colpisce le cellule del tumore è un “pennello” che si muove in modo simile a quello degli elettroni in un televisore e agisce con una precisione di 200 micrometri (due decimi di millimetro). In questo modo sezione per sezione il tumore viene distrutto: il passaggio da una sezione all’altra (più profonda) si ottiene aumentando l’energia del fascio. L’intero irraggiamento dura pochi minuti.
Testo redatto su fonte INFN del 13 febbraio 2014
Per approfondimenti: CNAO – Centro Nazionale di Adroterapia Oncologica – www.cnao.it
Image credit: CNAO
© Copyright ADEPRON – Riproduzione riservata

 ELETTROSTIMOLAZIONE CARDIACA
ELETTROSTIMOLAZIONE CARDIACA
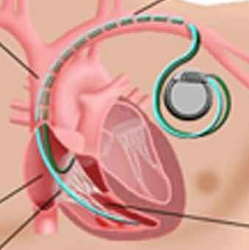
All’ospedale Molinette di Torino, grazie alle nanotecnologie, per la prima volta è stato eseguito un impianto di pace-maker senza fili di ultimissima generazione
22.12.2013
Testo dell’articolo
Il pacemaker è un dispositivo utilizzato dall’inizio degli anni ’60 per curare quei pazienti affetti da arresto cardiaco secondario a malattia del sistema elettrico del cuore (blocco atrio-ventricolare). L’impianto del pacemaker prevedeva essenzialmente due componenti: un generatore di impulsi inserito tramite un intervento chirurgico sotto la pelle del torace ed un elettrocatetere che, inserito attraverso delle vene, collegava questo generatore al cuore. I limiti di questo sistema che ha permesso in questi ultimi cinquant’anni di salvare milioni di vite umane sono la durata del catetere e la possibilità di infezioni che, partendo dalla cute dove viene impiantato il generatore, possono diffondersi fino al cuore. Negli anni le dimensioni dei pacemaker si sono progressivamente ridotte passando dai 100 grammi dei primi dispositivi ai 20-30 grammi di quelli attuali, ma più recentemente lo sviluppo delle nanotecnologie ha permesso di segnare l’inizio di una nuova era nella terapia dell’elettrostimolazione del cuore.
Di recente è infatti stato realizzato un pacemaker chiamato Nanostim talmente piccolo da poter essere posizionato direttamente all’interno del cuore senza la necessità di fili di connessione con l’apparecchio esterno. Il dispositivo viene introdotto direttamente nel cuore passando con un catetere “guida” attraverso una vena della gamba, il catetere “guida” viene successivamente rimosso senza richiedere nessuna incisione chirurgica della cute né successive cicatrici. L’impianto di questo pacemaker viene oggi proposto in primo luogo per quei pazienti ad elevato rischio di infezione o con problemi di accesso vascolare. Tale tecnologia è stata messa a disposizione di quattro centri di elettrofisiologia di eccellenza italiani, tra cui la Città della Salute e della Scienza di Torino che venerdì 20 dicembre ha effettuato con successo il primo impianto presso la Cardiologia Universitaria.
La paziente sottoposta a questo intervento innovativo è una donna di 83 anni affetta da una degenerazione del tessuto elettrico del cuore determinante un battito molto rallentato. Le numerose comorbilità della paziente però avrebbero comportato un elevato rischio infettivo in caso di impianto di pacemaker per via tradizionale. “Questo pacemaker miniaturizzato rappresenta una significativa innovazione tecnologica nel campo della cardiologia, consentendo di evitare le principali complicanze legate all’impianto dei pacemaker, ovvero il danneggiamento e l’infezione degli elettrocateteri. Oltre a queste significative novità strutturali il pacemaker Nanostim, nonostante le sue piccole dimensioni, vanta una durata della batteria fino a 8 anni e mezzo; trascorso tale tempo il pacemaker può essere “recuperato” con un apposito catetere e sostituito” afferma il Prof. Gaita.
Testo redatto su fonte Ospedale Molinette di Torino del 21 dicembre 2013 – www.cittadellasalute.to.it
© Copyright ADEPRON – Riproduzione riservata